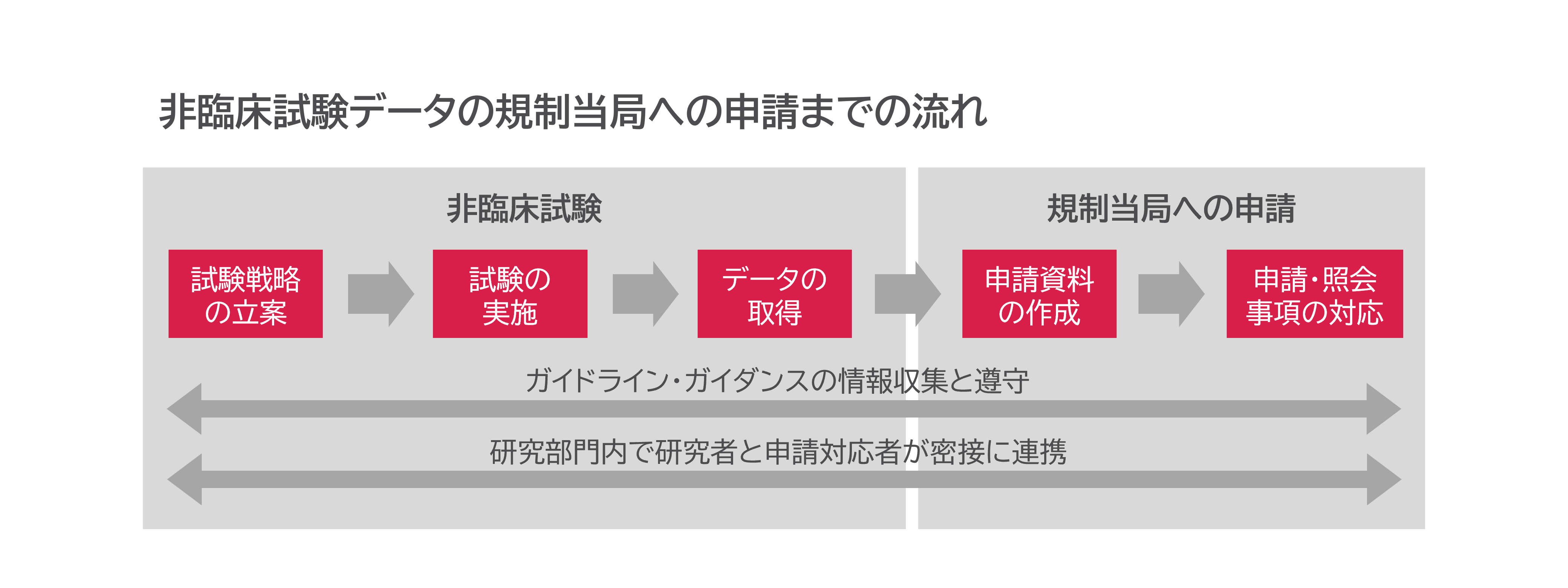
創薬研究で見出された開発候補品を実際に人に投与し、医薬品として発売できるかを判断するには、高質かつ信頼性の高い非臨床試験データが必要です。非臨床試験では、細胞や動物を用いて薬理試験、薬物動態試験および安全性試験を行います。レギュラトリーサイエンスはこのデータの取得や評価に関する活動全般を取り扱い、有効性や安全性を適切に評価することで、開発候補品が患者さんに届ける価値を最大化するとともに、リスクの最小化を図ります。これにより、臨床試験の開始や製品化の過程で必要な各国の規制当局の承認が円滑に得られるようになります。
アステラスでは、科学的根拠に基づき、規制当局への申請に必要な非臨床試験の計画の立案と実行、結果の文書化など幅広い業務を、研究部門で行っています。申請に向けたスケジュールを遅滞なく進め、新たな医薬品を早く患者さんに届けられるよう、戦略を立てて非臨床試験を進めています。
高質かつ信頼性の高い非臨床試験データ取得の戦略
- 科学的根拠に基づく、高質かつ信頼性の高い非臨床薬理試験、薬物動態試験、および安全性試験の立案と実行
- 研究開発段階に応じた最適な非臨床試験戦略の立案と遂行
- 臨床試験を安全かつ円滑に遂行するための非臨床試験データの取得
開発候補品の臨床試験を始める準備段階に進むと、最初に、基本的な特性を評価するための非臨床試験戦略を立案します。次に、最適な試験デザインや実施手順を十分に検討し、透明性と一貫性を確保して非臨床試験を行います。正確かつ客観的なデータを得られるよう規制当局のガイドラインを遵守して試験を管理し、統計的な手法を用いて結果の信頼性を確認します。
このように質の高い非臨床試験を行うことで信頼性の高いデータが得られ、患者さんの安全性を確保する基盤を築いています。
規制当局への申請
- 規制当局への申請資料のうち、非臨床試験に関する内容を作成
- 新薬臨床試験開始申請(IND)
- 新薬承認申請(NDA/BLA)
- 規制当局からの非臨床照会事項に対する回答書の作成
- 各国の規制情報、ガイドライン情報の集約
開発候補品として初めて人に投与する前から市販後まで、医薬品のライフサイクルの幅広い段階において、製薬会社は規制当局と連携しています。
具体的には、開発候補品・医薬品が患者さんに対して安全で有効であることを示すための基礎となる情報として、最新の科学に基づき、非臨床試験から得られたデータを文書にまとめて提供します。さらに、世界各国の規制当局からの照会事項に対して、信頼性の高いデータや最先端の知見を駆使して回答書を作成します。
また、最新の規制情報を集約し、ガイドラインやガイダンスを遵守して非臨床試験を実施することにより、申請までのスケジュールを迅速に進めています。