- 小児用プラジカンテル・コンソーシアムの一員として住血吸虫症に対する
小児用製剤の開発に貢献 -
アステラス製薬株式会社(本社:東京、代表取締役社長CEO:岡村 直樹、以下「アステラス製薬」)は、小児用プラジカンテル・コンソーシアム(以下、コンソーシアム)の一員として、顧みられない熱帯病の一つである住血吸虫症に対する小児用製剤の開発に貢献してきました。コンソーシアムは、就学期前児童(生後3カ月から6歳まで)の住血吸虫症の治療薬として開発中のarpraziquantelについて、欧州医薬品庁(European Medicines Agency:EMA)の欧州医薬品委員会(Committee for Medicinal Products for Human Use:CHMP)が12月15日(現地時間)に肯定的な科学的見解を示したことを発表しました。EMAは、欧州連合(European Union:EU)域外向けの優先度の高い医薬品について、EU-Medicines for all(EU-M4all)*1制度に基づき、arpraziquantelの審査を行いました。arpraziquantelの詳細については、コンソーシアムの発表を参照ください。
アステラス製薬は、コンソーシアムにおけるarpraziquantelの共同開発にあたり、革新的な製剤技術を供与しました。arpraziquantelは水に溶ける錠剤(150 mg)で、小児が服用しやすいように苦みが軽減されています。この小児用製剤は、プロトタイプ*2がアステラス製薬により開発、Merck(本社:ドイツ)により最適化され、高温多湿な熱帯地域においても安定性が高い錠剤を、簡素な製造プロセスでグローバルに製造できるようになりました。Farmanguinhos(所在地:ブラジル)が生産、流通の専門性を活かし、今後新たな小児用医薬品を蔓延国に導入するための製造拠点となります。Universal Corporation Ltd.(本社:ケニア)との提携により、将来アフリカ諸国において十分量を供給するために必要な、大規模な現地生産体制の構築に取り組んでいます。
規制当局による審査と並行して、コンソーシアムの実施研究「ADOPT*3プログラム」が進行中で、アフリカにおいて最初の蔓延国にarpraziquantelを導入する準備を行っています。arpraziquantelを、必要としている患者さんへ公平に届け、かつ患者さんが将来にわたって利用できるようにする(持続可能なアクセスを確保する)ためには、原料の調達や資金調達の新たな仕組みを共同で模索し、確立する必要があります。ADOPTプログラムは、サハラ以南のアフリカ諸国で原価ベースでの製品供給を目指しています。
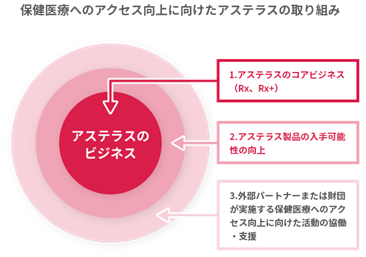
アステラス製薬は、経営計画2021における戦略目標の一つに「サステナビリティ向上の取り組みを強化」を掲げています。保健医療へのアクセス向上(Access to Health:ATH)を最重要課題の一つと捉え、(1)アステラスのコアビジネス(Rx, Rx+)、(2)アステラス製品の入手可能性の向上、(3)外部パートナーが実施する保健医療へのアクセス向上に向けた活動の協働・支援、という3つのアプローチで、包括的な取り組みを行っています。コンソーシアムでの活動は(3)に該当し、arpraziquantelのEMAによる肯定的な科学的見解は、アステラス製薬が取り組むATH課題の解決に向けた大きな一歩となりました。
アステラス製薬の代表取締役社長CEOである岡村 直樹は、「arpraziquantelがEMAから肯定的な科学的見解を得たことを大変嬉しく思います。そして、私たちの革新的な製剤技術が、この製品の開発に貢献できたことを誇りに思います。ATHは世界中の人々の健康にとって不可欠であり、アステラス製薬にとって最重要課題であると認識しています。私たちのVISION「変化する医療の最先端に立ち、科学の進歩を患者さんの『価値』に変える」の実現に向け、今後もATHの課題解決に包括的に取り組んでいきます」と述べています。
アステラス製薬のarpraziquantel開発への貢献についてはこちらをご覧ください。
以上
*1 EU-M4all:EU-M4allは、EU域外への、ワクチンを含む優先度の高い医薬品への患者アクセスを促進することを目的とした制度です。この制度に基づき、EMAのCHMPは医薬品を審査し、肯定的な科学的見解を示すことができます。この肯定的な科学的見解を持って、世界保健機関(WHO)による事前認証が行われ、対象となる国における規制当局の審査をサポートします。詳細はEMAのウェブサイトをご覧ください。
*2 プロトタイプ:原型、最初に形にしたもの
*3 ADOPT:Adoption of Levo-Praziquantel 150 mg for schistosomiasis by endemic countries
住血吸虫症について
住血吸虫症(別名:ビルハルツ住血吸虫症)は、世界で最も蔓延している寄生虫疾患の一つで、公衆衛生上の負担が大きく、経済的な影響をもたらします。貧困との関連性が高く、清潔な水にアクセスできない熱帯、亜熱帯地域において蔓延しています。住血吸虫によって引き起こされる疾患で、人々が生活の中で淡水に触れる際に寄生虫に感染します。小さな幼虫が人間の皮膚から血管に入り込み、臓器を攻撃します。住血吸虫症は慢性疾患であり、子供の感染率が特に高く、世界保健機関(WHO)によって分類される20の顧みられない熱帯病(NTDs)の1つです。
arpraziquantelについて
住血吸虫症に対する現在の標準治療にはプラジカンテルが用いられています。プラジカンテルは安全で有効であり、就学児や成人の治療に適しています。arpraziquantelは、未就学児のマンソン住血吸虫症やビルハルツ住血吸虫症に対する治療選択肢を広げるために開発されました。Merckが主導した臨床開発において、arpraziquantelは、プラジカンテルの薬理活性を有するエナンチオマー(鏡像異性体)を含んでいることが証明されました。arpraziquantelの開発にあたり、小児用プラジカンテル・コンソーシアムは、前臨床開発、臨床開発、登録、アクセスの4つの主要なステップに分かれた小児医薬品開発プログラムを確立しました。詳細はコンソーシアムのウェブサイトを参照ください。
小児用プラジカンテル・コンソーシアムについて
小児用プラジカンテル・コンソーシアムは、国際的な官民パートナーシップで、住血吸虫症に感染した就学前児童の保健医療アクセスを改善することにより、住血吸虫症という世界的な疾病による苦痛を軽減することを目的としています。生後3カ月から6歳の小児の住血吸虫症を治療するための適切な小児用医薬品を開発、登録、および持続的なアクセスの提供をミッションとしています。詳細はコンソーシアムのウェブサイトを参照ください。
コンソーシアムパートナー
・Merck (Germany)
・Astellas Pharma Inc. (Japan)
・The Swiss Tropical and Public Health Institute (Switzerland)
・Lygature (The Netherlands)
・Farmanguinhos (Brazil)
・Unlimit Health (United Kingdom)
・Kenya Medical Research Institute (Kenya)
・Université Félix Houphouët-Boigny (Côte d'Ivoire)
・Klinikum rechts der Isar der Technischen Universität München (Germany)
・Ministry of Health Côte d'Ivoire (Côte d'Ivoire)
・African Institute for Health and Development (Kenya)
その他提携先
・Makerere University School of Public Health (Uganda)
・Ministry of Health Kenya, Division of Vector Borne and NTDs (Kenya)
・Ministry of Health Uganda, Vector Borne and NTDs Control Division (Uganda)
アステラス製薬株式会社について
アステラス製薬は、世界70カ国以上で事業活動を展開している製薬企業です。最先端のバイオロジーやモダリティ/テクノロジーの組み合わせを駆使し、アンメットメディカルニーズの高い疾患に対する革新的な医薬品の創出に取り組んでいます(Focus Areaアプローチ)。さらに、医療用医薬品(Rx)事業で培った強みをベースに、最先端の医療技術と異分野のパートナーの技術を融合した製品やサービス(Rx+®)の創出にも挑戦しています。アステラス製薬は、変化する医療の最先端に立ち、科学の進歩を患者さんの「価値」に変えていきます。アステラス製薬の詳細については、(https://www.astellas.com/jp/)をご覧ください。
注意事項
このプレスリリースに記載されている現在の計画、予想、戦略、想定に関する記述およびその他の過去の事実ではない記述は、アステラス製薬の業績等に関する将来の見通しです。これらの記述は経営陣の現在入手可能な情報に基づく見積りや想定によるものであり、既知および未知のリスクと不確実な要素を含んでいます。さまざまな要因によって、これら将来の見通しは実際の結果と大きく異なる可能性があります。その要因としては、(i)医薬品市場における事業環境の変化および関係法規制の改正、(ii)為替レートの変動、(iii)新製品発売の遅延、(iv)新製品および既存品の販売活動において期待した成果を得られない可能性、(v)競争力のある新薬を継続的に生み出すことができない可能性、(vi)第三者による知的財産の侵害等がありますが、これらに限定されるものではありません。また、このプレスリリースに含まれている医薬品(開発中のものを含む)に関する情報は、宣伝広告、医学的アドバイスを目的としているものではありません。