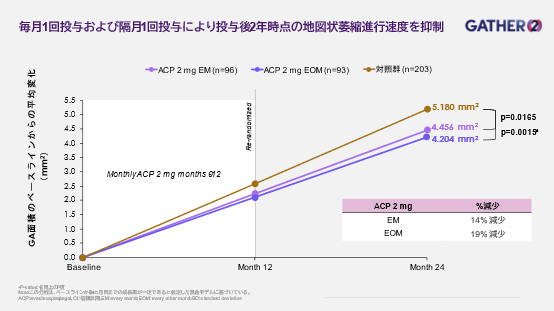
- 毎月1回投与および隔月1回投与により投与後2年時点の地図状萎縮進行速度を抑制 -
- 2年間の治療効果は1年間の治療効果と比べて2倍以上 -
- 投与後2年間の安全性データは、1年の時点と同様の結果であり、虚血性神経障害や網膜血管炎の症例は見られず -
- 偽処置対照群と比較して、2年間の脈絡膜新生血管の発生率はわずかな増加のみ観察、2年目の隔月1回投与における発生率は同等 -
- 2年間の15文字以上の持続的な視力低下のリスクを、偽処置対照群と比較して統計学的に有意に軽減せず -
アステラス製薬株式会社(本社:東京、代表取締役社長CEO:岡村 直樹、以下「アステラス製薬」)は、地図状萎縮(Geographic Atrophy:GA)を伴う加齢黄斑変性(Age-related Macular Degeneration:AMD)の治療剤である補体因子C5阻害剤IZERVAYTM(一般名:avacincaptad pegol、以下「ACP」)硝子体内注射液の第III相GATHER2試験の結果を米国サンフランシスコで開催された2023年米国眼科学会(American Academy of Ophthalmology:AAO)年次総会で口頭発表しました。
本試験では、GAを伴うAMD患者を対象にしたACPの毎月1回(Every Month:EM)投与および隔月1回(Every Other Month:EOM)投与のいずれにおいても、偽処置対照群と比較して2年間の投与期間中にGAの進行速度を継続的に低下させることが明らかになりました。また、ACPによるGA治療効果は投与後6カ月から観察され、2年間経時的に増大し続け、2年間のEMおよびEOM投与による治療効果は1年間の治療効果と比べて2倍以上でした。試験結果の概要は以下の通りです。
- ACPを2年間EM投与された群では、偽処置対照群と比較して、GATHER2試験の投与後2年時点の解析における主要評価項目であるGA進行の平均速度が統計学的に有意に減少しました。投与後2年時点でのGA進行の平均速度が14%減少しました(p=0.0165)。
- ACPを1年間EM投与され、その後1年間EOM投与された群では、偽処置対照群と比較して、投与後2年時点でGA進行の平均速度が19%減少しました(名目上のP値 p=0.0015)。
- 2年間のACPの治療効果は1年間の治療効果と比べて2倍以上でした。
- ACP投与群は、偽処置対照群と比較して、2年間の15文字以上の持続的な視力低下のリスクを、統計学的に有意に軽減しませんでした。持続的視力低下については複数の感度分析を用い検討をしていく予定です。
- ACPは2年間にわたり良好な忍容性を示し、重篤ではない眼内炎症と感染性眼内炎の症例がそれぞれ1件見られましたが、虚血性神経障害や網膜血管炎の症例は見られませんでした。
- 偽処置対照群と比較し、2年間のACP処置群における脈絡膜新生血管(choroidal neovascularization:CNV)の発生率はわずかな増加のみが観察され、2年目のEOM投与における発生率は同等でした。
2年間の投与期間に発生した有害事象(Treatment Emergent Adverse Events:TEAE)は、1年の時点と同様の結果であり、眼におけるTEAEはACP投与群の64.0%、偽処置対照群の48.2%で観察されました。
- ACP投与群で偽処置対照群と比較して多く見られた眼におけるTEAEは、結膜出血(16.9% vs. 9.0%)、眼圧上昇(13.3% vs. 0.9%)、CNV(11.6% vs. 9.0%)でした。
- 重篤な眼のTEAEは、ACP投与群と偽処置対照群で同等でした(1.8% vs. 0.9%)。投与後2年目において、ACP投与群では感染性眼内炎が1例、眼内レンズ亜脱臼が1例見られたのに対し、偽処置対照群では見られませんでした。
IZERVAYTMは、GAを伴うAMDの治療剤として、米国食品医薬品局(Food and Drug Administration:FDA)から2023年8月4日(現地時間)に承認を取得しており、欧州医薬品庁(European Medicines Agency:EMA)が販売承認申請の審査中です。
本件によるアステラス製薬の業績への影響は、通期(2024年3月期)連結業績予想に織り込み済みです。
以上
GATHER2試験について
GATHER2試験は無作為化二重盲検偽処置対照多施設共同の第III相試験で、GAを伴うAMD患者448人が組み入れられ、ACPを硝子体内投与した場合の安全性と有効性を評価しました。ACPは投与後1年時点において、主要評価項目を達成しました。最初の1年間は、毎月1回ACP 2 mgを投与される群と偽処置対照群に無作為に割り付けられました。投与後1年以降、ACP投与群は毎月1回ACPを投与される群(n=96)と2カ月に1回ACPを投与される群に再割り付けされました(n=93)。偽処置対照群はそのまま偽処置を受け続けました(n=203)。ACPに関するより長期のデータを得るために非盲検試験が継続中です。
地図状萎縮(Geographic Atrophy:GA)を伴う加齢黄斑変性(Age-related Macular Degeneration:AMD)について
加齢黄斑変性(AMD)は、高齢者における中等度から重度の中心視力低下の主な原因であり、患者の大半は両眼を侵されています。黄斑は網膜の中心部にあるわずかな領域で、中心視力をつかさどっています。AMDが進行すると、黄斑部の網膜色素上皮細胞とその下部にある血管が失われ、網膜組織が著しく薄くなったり、萎縮したりします。地図状萎縮(GA)を伴うAMDは、患者さんの視力を不可逆的に低下させます。
アステラス製薬株式会社について
アステラス製薬は、世界70カ国以上で事業活動を展開している製薬企業です。最先端のバイオロジーやモダリティ/テクノロジーの組み合わせを駆使し、アンメットメディカルニーズの高い疾患に対する革新的な医薬品の創出に取り組んでいます(Focus Areaアプローチ)。さらに、医療用医薬品(Rx)事業で培った強みをベースに、最先端の医療技術と異分野のパートナーの技術を融合した製品やサービス(Rx+®)の創出にも挑戦しています。アステラス製薬は、変化する医療の最先端に立ち、科学の進歩を患者さんの「価値」に変えていきます。アステラス製薬の詳細については、(https://www.astellas.com/jp/)をご覧ください。
Iveric Bioについて
アステラス製薬の子会社であるIveric Bioは、アンメットメディカルニーズの高い網膜疾患の新規治療薬の研究開発に注力しているサイエンス主導型のバイオ医薬品企業です。加齢黄斑変性症の初期段階を含む網膜疾患の治療に対する、高品質かつ安全で効果の高い治療薬を提供することにより、患者さんに新たな「価値」を届けることを目指します。Ivery Bioの詳細については、(http://www.ivericbio.com.)をご覧ください。
注意事項
このプレスリリースに記載されている現在の計画、予想、戦略、想定に関する記述およびその他の過去の事実ではない記述は、アステラス製薬の業績等に関する将来の見通しです。これらの記述は経営陣の現在入手可能な情報に基づく見積りや想定によるものであり、既知および未知のリスクと不確実な要素を含んでいます。さまざまな要因によって、これら将来の見通しは実際の結果と大きく異なる可能性があります。その要因としては、(i)医薬品市場における事業環境の変化および関係法規制の改正、(ii)為替レートの変動、(iii)新製品発売の遅延、(iv)新製品および既存品の販売活動において期待した成果を得られない可能性、(v)競争力のある新薬を継続的に生み出すことができない可能性、(vi)第三者による知的財産の侵害等がありますが、これらに限定されるものではありません。また、このプレスリリースに含まれている医薬品(開発中のものを含む)に関する情報は、宣伝広告、医学的アドバイスを目的としているものではありません。