全世界對利用細胞療法所帶來巨大潛力的期望越來越高。安斯泰來與多家公司和研究機構專注於這項任務,在此應用方面也取得了重大的進展。
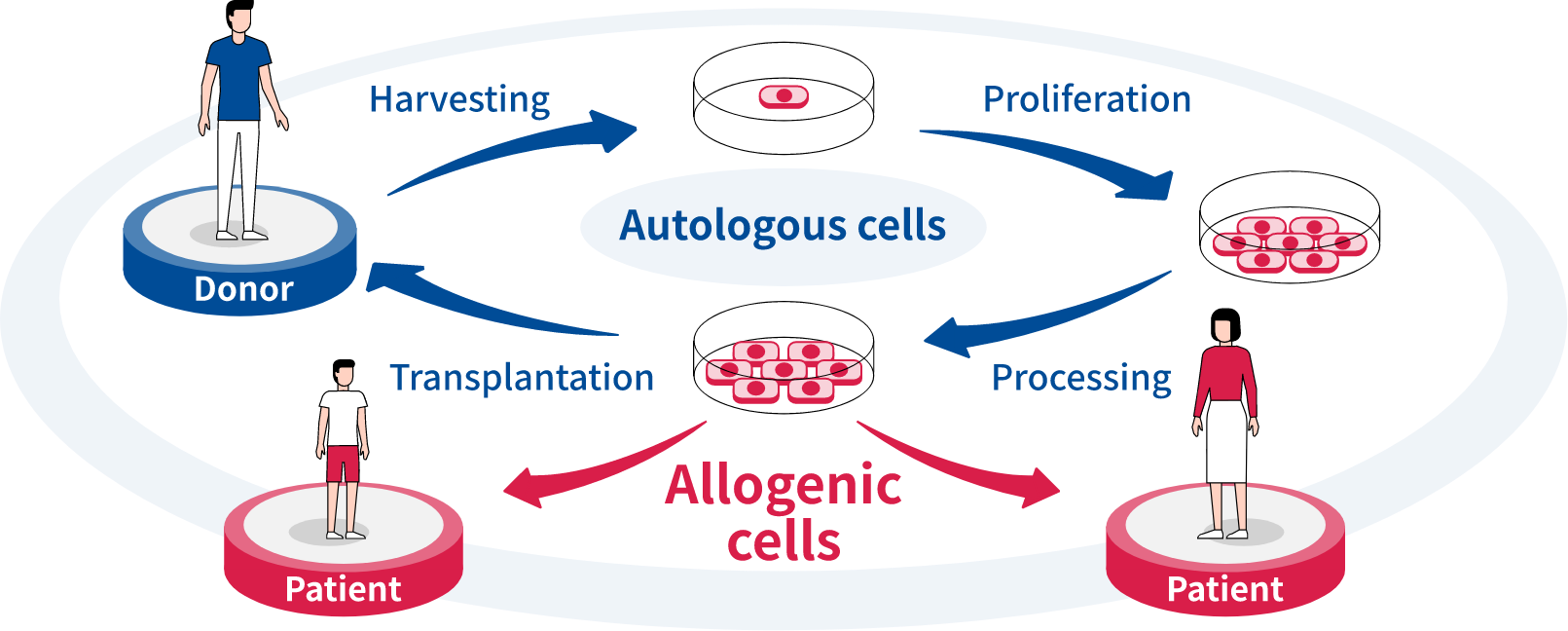
我們在細胞治療方法專注於研究利用同種異體多能幹細胞 (PSC*) 衍生的分化細胞進行治療。這些細胞適合商業化,因為它們可以大規模生產,現成可用,並且比自體細胞療法成本更低。我們目前正在眼科領域進行臨床試驗,並致力於進一步加強開發產品線,重點關注自體免疫性疾病、心血管疾病和癌症等醫療需求尚未得到滿足的領域。
*PSC-多能幹細胞的縮寫。
提供給患者-更容易獲得的細胞治療選擇
2030 年將是我們發展時程上一個重要的時間點。我們相信,隨著細胞療法在可治療的疾病和症狀範圍的擴大,以及現成產品的廣泛銷售,使更多患者可以獲得治療,我們相信市場將顯著擴張。預計 2030 年全球市場將增長至 12 萬億日元,2050 年將增長至 38 萬億日元*1,商業化競爭也將隨之加劇。
考慮到這一點,我們在美國麻州大波士頓地區的安斯泰來再生醫學研究所(AIRM- Astellas Institute for Regenerative Medicine)鞏固了細胞療法研發基地。該研究所所長Masahide Goto博士解釋了安斯泰來獨特而創新的活動:
“我們正專注於同種異體PSC衍生的分化細胞進行治療,這是一種具有挑戰性的方法。然而,與自體多能幹細胞(取自患者本身,於體外繁殖,再返回體內的細胞)相比,同種異體PSC衍生的分化細胞可以在極短的時間內進行治療,並符合廣泛的需求。”
Goto指出安斯泰來面臨的挑戰之一:同種異體PSC衍生的分化細胞面臨免疫排斥問題,並且隨著生產價值鏈中的進程-從人造環境中進行的實驗到動物、再從動物到人類,至新的障礙出現,然後量產。他也強調了合作夥伴關係的力量。 “透過建立適當的伙伴關係和其他措施,我們克服了許多問題。”
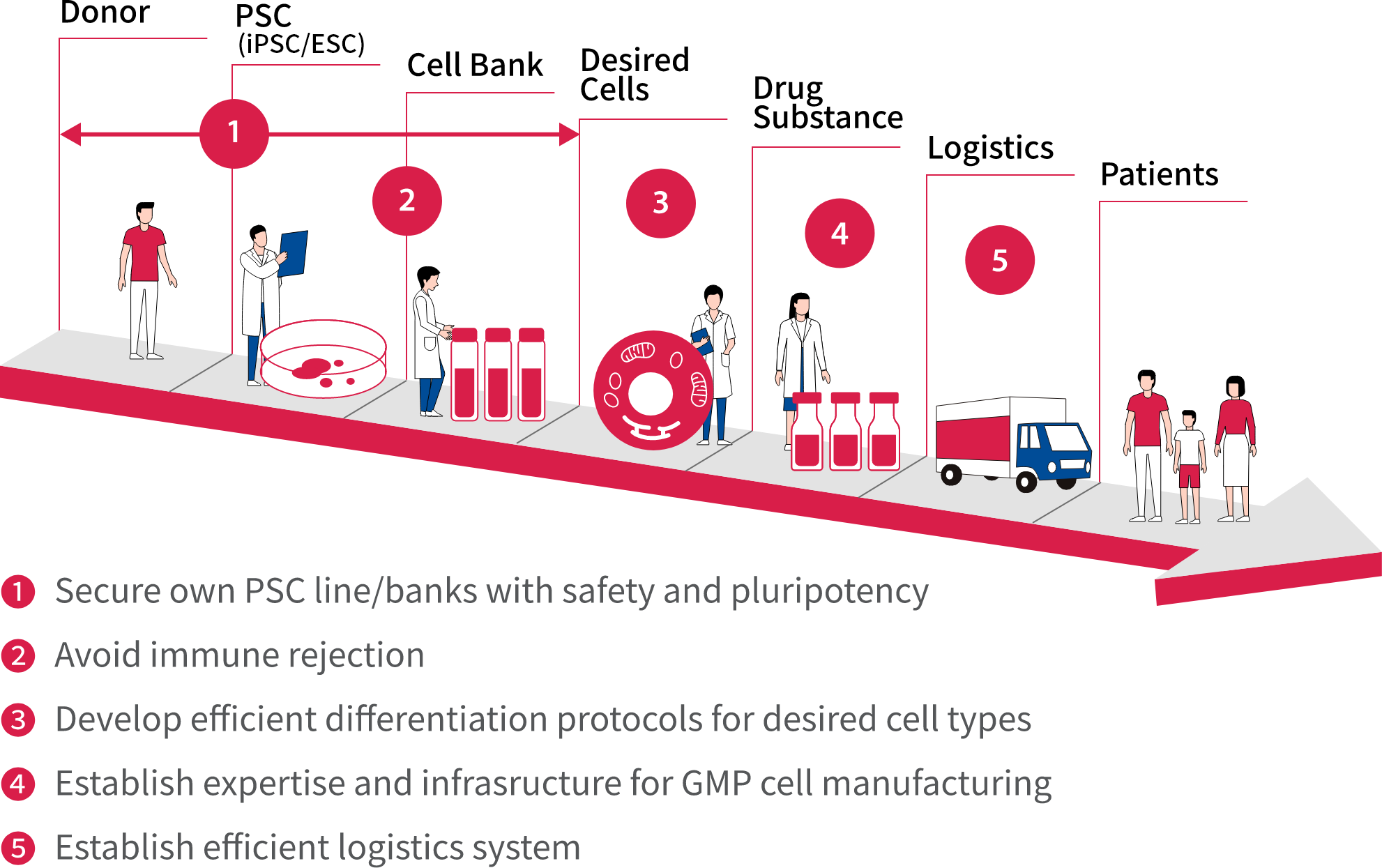
AIRM目前專注於擴展我們強大的基礎幹細胞技術,推動我們在安全和質量皆有保證的多能幹細胞產品線,完整了我們針對所需細胞類型的有效分化方案,並利用技術避免免疫排斥。
該研究所在優良製造規範(GMP)下,不論開發大規模生產能力和建構高效物流系統上皆進展順利。
安斯泰來利用藥品多樣化的製造技術,使公司處於優勢地位。我們透過開發,將技術用於細胞製造的內部實踐並取得了重大進展。這些努力將有助於促進藥物管理以及解決運輸等後勤問題以增加患者治療設備的數量。
*1 經濟產業省“再生醫學和基因治療產業化基礎技術開發多任務計劃綱要”。
引領眼科領域-臨床試驗正在進行中
安斯泰來正在眼科領域進行一項視網膜色素上皮細胞計劃的臨床試驗,用於治療地圖狀萎縮的老年性黃斑部病變。我們還開發針對青光眼、色素性視網膜炎和其他眼疾的多個產品線。除了眼科,我們正在研究基於細胞的治療領域,包括用於治療克隆氏症等自體免疫性疾病的成血管細胞來源的給予間質幹細胞,以及用於治療嚴重肢體缺血的脈管前驅細胞和癌症的各種細胞類型。
Goto解釋說,最初關注眼科的原因有很多,包括品質保證和物流方面的許多優勢 - 眼睛可以直接接觸到,並且無需全身麻醉即可處理。而與其他器官相比,眼睛較小,因此所需要的細胞數量也較少。
Goto再次強調安斯泰來在細胞治療領域採取的決定性步驟。安斯泰來之所以能夠領導眼科領域臨床試驗的一個重要因素是 2016 年收購了美國生物技術公司Ocata Therapeutics。透過安斯泰來旗下的Ocata,我們同時收購該公司領先的臨床項目。Ocata當時是一個 30 多人的組織,在幹細胞分化誘導研究方面有很多成果,這些技術在安斯泰來的臨床試驗也得到大量的應用。此外,Ocata的Robert Lanza博士也扮演了重要的角色。他被認為是在細胞治療領域中世界頂尖的科學家之一,目前也作為AIRM的首席科學官帶領我們。
創新中心-
以應用人才的能力作為我們的研究基礎
2020年1月,新的AIRM於波士頓附近竣工。總建築面積24000平方米,集細胞治療研究、臨床開發、GMP生產之大成,是廣闊且先進的基地。這是一座令人印象深刻的建築,也是我們才華橫溢的團隊,努力創新推動的成果。在該機構工作的多元團隊扮演著各種角色,他們團結一致,以解鎖細胞療法的潛力並滿足全球患者的需求。
“AIRM在細胞治療和相關領域擁有世界一流的科學家,與世界一流的研究合作夥伴和世界一流的設備合作展開我們的研究和製造。這意味著我們擁有許多在細胞療法及其他領域進行先進研究不可或缺的能力,包括多能幹細胞來源、基因編輯和細胞類型分化。在我的營運角色中,我的目標是支持研究團隊,使他們能夠順利、安全地實現目標,並追求創新科學,為患者創造價值,使 AIRM成為外部合作對象的首選夥伴。”
Richard Cassidy
營運和商業化負責人
我目前在AIRM負責的是產品線的戰略規劃以及管理參與再生醫學研究和早期產品開發的科學家團隊。AIRM的工作環境將小型生物技術公司的創新與大型製藥公司的全球基礎設備、資源和支持相結合,這使我們能夠看到產品從早期的建立與合作到IND紀錄、臨床試驗和商業發布。透過我在細胞治療研究中的角色,我的目標是協助安斯泰來實現多能幹細胞療法的驚人潛力,為醫療需求未得到滿足的患者帶來價值。
Erin Kimbrel
再生醫學執行董事
我尋求能夠讓我們改善細胞或加速分化過程的轉錄因子。我目前也正在與 Ocular團隊合作,採用類似的策略,利用轉錄因子在視網膜中產生不同的細胞類型。我很幸運能夠將我在表觀遺傳學和重編程方面的專業知識與轉錄因子結合,並將它們應用於再生醫學應用的轉化研究。 AIRM的文化、種族和性別多樣性為科學討論和合作提供了友好的環境。每個人除了在自己的職責上努力工作,但仍有時間協助他人,討論科學計劃。這種多學科的合作對我們的成功甚為重要。
Ana D'alessio
Ocular團隊首席科學家
面對未來-開發細胞治療平台
安斯泰來的重點領域方法(Focus Area Approach)確立了我們投資資源的優先領域。在發現多個新藥候選項目且先導化合物已進入臨床階段後,優先考慮特定領域,我們將其指定為主要焦點。
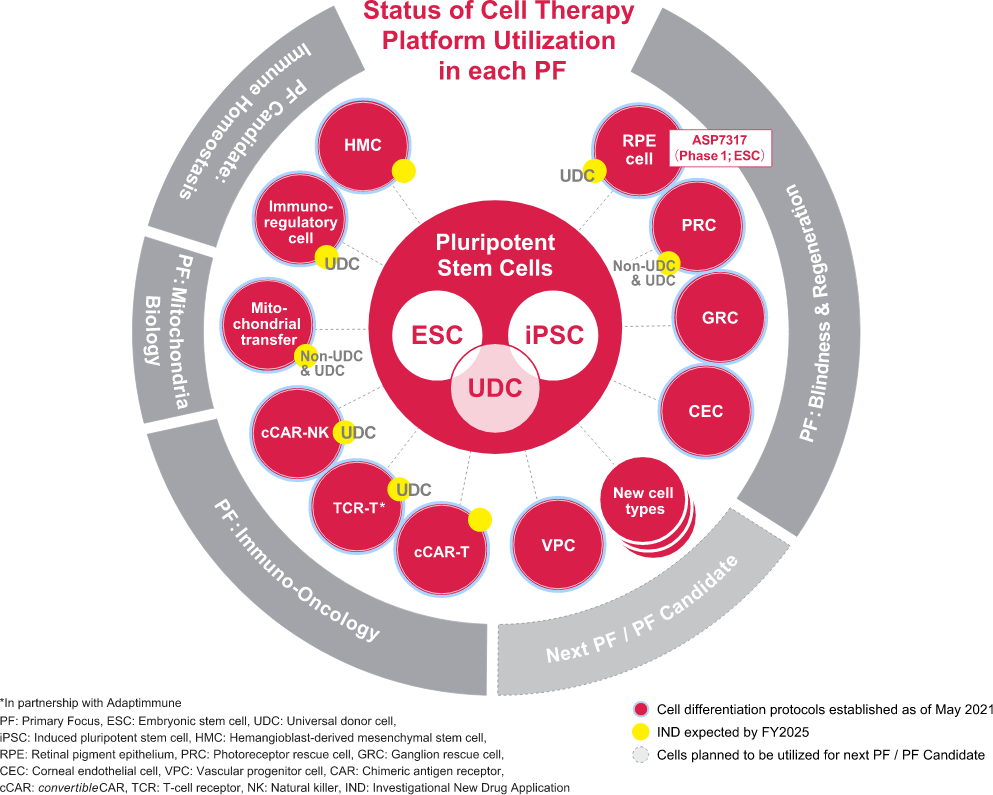
目前指定為主要重點的四項措施是失明與再生、線粒體生物學、遺傳調控和免疫腫瘤學。該細胞治療平台僅用於主要焦點失明和再生,但現在已用於多個主要焦點,如免疫腫瘤學和線粒體生物學。在過去的三年裡,我們成功地擴大了產品線。我們正在努力開發一個細胞治療平台,到2025年可以應用於各種疾病領域。
Goto解釋說,該公司目前處於第一波細胞療法的研發階段。“首先,我們必須確保將領先的項目與患者治療連結起來,並建立價值鏈的基礎。然後,利用技術來防止免疫排斥-同種異體PSC衍生分化細胞的大問題-目前我們正在為第二波產品開闢道路。”
第二波的核心是Universal Cells Inc.開發的全適供血者細胞(UDC)技術,該公司於 2018 年被安斯泰來收購。 UDC技術可用於建立細胞治療產品,無需任何受體即可給藥,用於人類白血球抗原 (HLA) 配對。該技術基於rAAV(重組腺相關病毒)的基因編輯和多能幹細胞的細胞工程。透過這項技術,我們能夠將平台擴展到眼科以外的領域,如自體免疫性疾病、癌症和線粒體疾病。
在第三波細胞治療研發浪潮中,我們的目標是將多能幹細胞技術與基因編輯或基因增強技術相結合,以創造下一代功能增強的細胞。 Goto解釋說,安斯泰來正要開啟這一段旅程:
“基礎科學才正要開始,我們將探索使用以前看不見的細胞療法的可能性。例如,置入滋養因素,當細胞中包含的功能起作用時會釋放這些營養因子,從而使附近的細胞健康。”
細胞療法是下一代備受全球關注的治療方式。在安斯泰來,我們使用供體來源的多能幹細胞開發的細胞療法令人非常自豪,我們的團隊在該領域處於全球前端。我們將努力進一步充實和加強團隊,同時積極採用先進科學,實現細胞治療的突破性潛力。
Robert Lanza博士(AIRM首席科學官)
負責管理多個跨治療領域,以細胞為基礎的再生醫學產品開發,同時提供戰略方向和領導。我與AIRM的領導和研究團隊密切合作,開發和實施 Astellas/AIRM再生醫學(RM)科學願景並提供尖端生物科學。這需要與安斯泰來的其他研究、管理和臨床同事以及全球領先的學術團隊密切合作。透過我在RM的角色,我的目標是探索幹細胞療法的深遠潛力,並以一種大膽的新方式治療目前無法治癒的疾病。
專業術語
研究新藥(IND):
美國新藥必備的臨床試驗通知系統。在美國,必須在臨床試驗開始前向美國食品和藥物管理局(FDA)提交一份新藥研究申請。
地圖狀萎縮的老年性黃斑部病變(AMD):
老年性黃斑部病變是一種由於紫外線、吸煙、遺傳、生活方式和其他因素導致中央視網膜(黃斑)惡化,造成視力喪失的疾病。有兩種類型的黃斑病變,滲出型和萎縮型。當黃斑後面形成異常血管時發生滲出型。當黃斑逐漸退化時出現萎縮型。在某些情況下,萎縮區域類似於執行視網膜檢查的醫生地圖,因此稱為“地圖萎縮”。目前未有針對萎縮型黃斑性病變有效的治療方法。
全適供血者細胞(UDC)技術:
全適供血者細胞(UDC)技術產生多能幹細胞,可抑制由於患者的人類白血球抗原(HLA)類型的不相容性所引起的免疫排斥。透過對要移植的細胞進行基因編輯,從細胞中去除HLA,成為單一的免疫抑制性HLA-E。它不需要免疫抑製藥劑,可用於周邊疾病。