私たちの研究活動
ダイレクトリプログラミング研究ユニットは、つくば研究センターを拠点とし、2022年8月に設立されました。
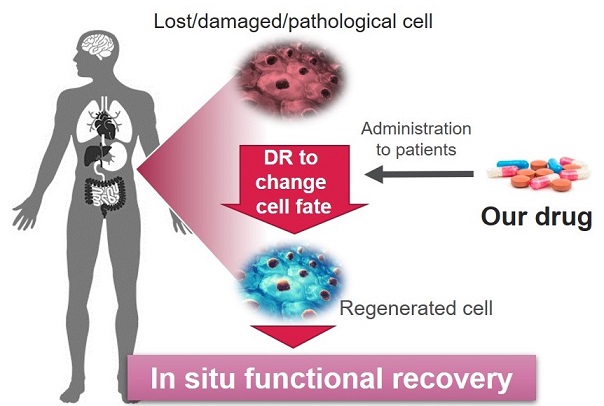
私たちの目標は、ダイレクトリプログラミングを応用して、現在治療薬が限られている慢性的な難治性疾患(例えば、慢性期にある神経変性疾患、各種線維化疾患等)における機能不全を恒久的に再生・回復する新薬の創出です。これにより、患者さんがより自立した生活を取り戻せるようになることを期待しています。

私たちのサイエンス
次世代再生医療
ダイレクトリプログラミングは、転写因子の制御により、多能性幹細胞を介さずに細胞の運命を直接変換するバイオロジーです。生体内でダイレクトリプログラミングを可能にする技術は、新たな再生医療技術として注目を集めています。
ダイレクトリプログラミングはこれまでの治療とは違い、不要な細胞を除去する、もしくは必要な細胞を補充するだけでなく、不要な細胞を必要な細胞に変換することを可能にします。そのため、治療や治癒ができないと考えられてきた難治性疾患に対しても高い有効性を示すことが期待されています。また、細胞を直接投与する細胞医療ではなく、生体内で目的の細胞をつくりだすことが可能となるため、細胞医療で課題となっている免疫排除、生着率、および腫瘍化のリスクをも回避することにもつながると期待されます。
メカニズム
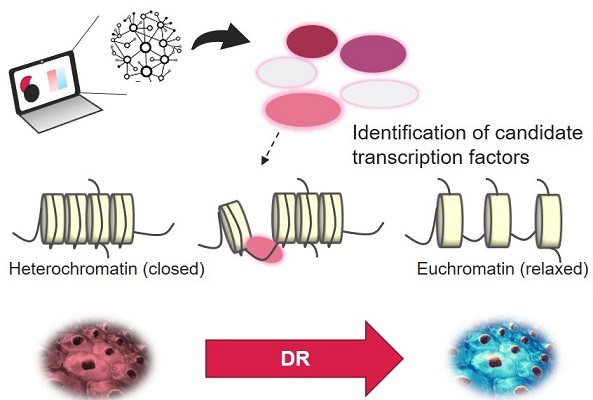
一度決められた細胞の運命を書き換えるこの現象の多くには、転写因子 / 転写共役因子による DNA やヒストンへの後天的修飾 (エピジェネティクス)の関与が報告されています。山を下るように一方向だと考えられていた細胞の運命は、リプログラミングという初期化プロセスの発見により覆り、このダイレクトリプログラミングにより、細胞運命が多方向に分岐する事が注目されています。例として、グリア細胞から神経細胞、線維芽細胞から肝実質細胞、心筋細胞、B細胞から血球細胞、マクロファージなどが報告されています。
アプローチ
① 病原細胞より目的細胞へダイレクトリプログラミングを可能とする因子の探索:共同研究、並びに独自のin silico技術を用いた因子探索を行います。
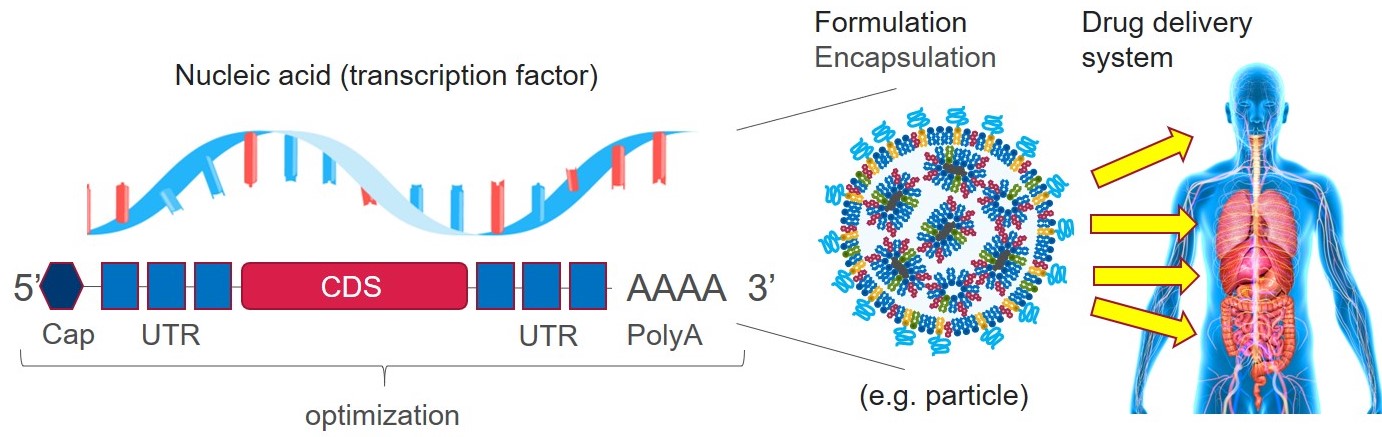
② 創薬モダリティ:ダイレクトリプログラミングを可能とする転写因子を病原細胞・脆弱細胞に送達するためのモダリティとして非ウイルス製剤(RNA, lipid nanoparticleなど)を利用します。
③ 病態モデル:臨床予測性を高めるために、ヒト慢性期の難治性疾患を再現し得るげっ歯類や霊長類の病態モデル、ヒトの臨床サンプルを効果的に利用します。
研究を進めるにあたっては、アカデミアやバイオベンチャーと協働して、各過程の一層の加速化・高質化を図っています。
チーム

ユニット長
博士(薬学)
中原 聡一郎
入社後、薬理研究員として神経領域、感覚器領域で創薬研究を担い、2つの開発候補品を創出。病態中間表現型遺伝学を解明する国際コンソーシアム(ENIGMA)の中の脳機能―表現型―遺伝子解析グループをリード(https://enigma.ini.usc.edu/)、また複数の学術論文を発表。その後、ダイレクトリプログラミング研究に立ち上げから関わり、研究ユニットの基盤となる特許発明を行った。2022年8月より現職。
プレスリリース
- 順天堂大学とのダイレクトリプログラミング再生医療学講座開設
https://www.astellas.com/jp/system/files/news/2021-10/20211001_jp_1_1.pdf - Pantherna社とのmRNAを用いた革新的な再生医療プログラム創出を目指し技術検証研究に関する契約
https://www.astellas.com/jp/news/17386
パートナーシップ
アステラスが外部パートナーに期待するアセットおよびケイパビリティ
- 細胞実験または生体実験において、目的の細胞へのダイレクトリプログラミングを誘導する因子の探索・検証 (e.g. ダイレクトリプログラミングを達成しうる因子の探索基盤を有している。または、既にダイレクトリプログラミングを達成する因子を同定・有しており、その効果を検証している。)
- 上記のダイレクトリプログラミングを制御できる非ウイルス製剤の創製・改良、または複数の転写因子を発現・制御する技術 (e.g. 複数の転写因子遺伝子をタンデムに繋ぐ、もしくは環状に繋ぎ、遺伝子発現を達成する核酸など。)
- 目的の組織・細胞に非ウイルス製剤を送達する技術 (e.g. 核酸を線維芽細胞に送達するLipid nanoparticle、もしくは届けたい任意の細胞に併せて送達技術をスクリーニングできる技術基盤)
採用情報
ダイレクトリプログラミングの技術を通して、慢性期難治性疾患の患者さんへの創薬を実現されたい方と一緒に活動したいと考えております。ご興味がございましたら、こちらまでお問い合わせください。