アステラス製薬株式会社(本社:東京、代表取締役社長CEO:安川 健司、以下「アステラス製薬」)は、腹部および骨盤内手術時に尿管を可視化する蛍光造影剤: ASP5354の開発について、米国食品医薬品局(FDA)からファストトラック指定を受けました。FDAによるファストトラック指定制度は、アンメットメディカルニーズが高い重篤または生命を脅かす恐れのある疾患に対する治療薬の開発および審査の迅速化を目的としています。ASP5354のファストトラック指定により、手術中に尿管を可視化する新たなアプローチの早期実用化が期待されます。
ASP5354は、消化器の外科手術や婦人科における子宮摘出手術等、腹部および骨盤内手術の際に、誤って尿管を傷つけてしまう医原性尿管損傷(iatrogenic ureteric injury: IUI)のリスクを低減するために、アステラス製薬におけるRx+®事業*1のひとつとして開発が進められている蛍光造影剤です。IUIは尿管の狭窄や閉塞、尿管と膣との瘻孔、急性または慢性腎不全、敗血症などの長期にわたる合併症を引き起こします。米国における200万例を超える手術症例調査によると、IUIの罹患率や死亡率が高いことに加え、尿管再建手術によるIUIの治療のために長期の入院が必要となるため、その医療費が大変高額になっていることが示されています*2。
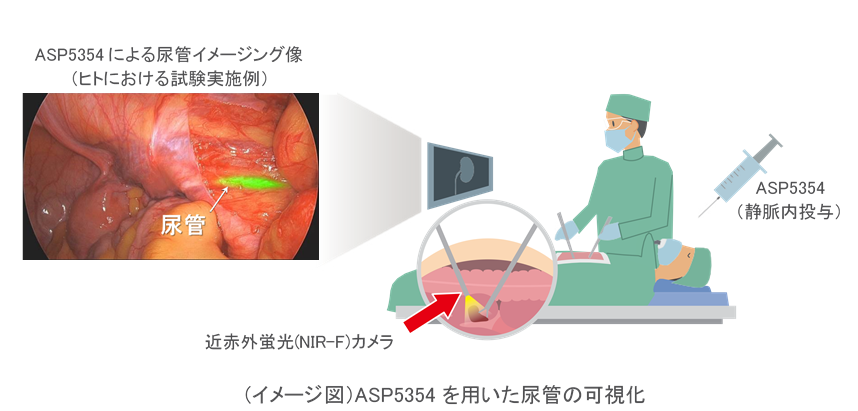
ASP5354は、近赤外蛍光(near-infrared fluorescence: NIR-F)で励起すると蛍光を発するインドシアニングリーン(ICG)の誘導体です。ASP5354を静脈内に投与すると、迅速に尿管へ移行し、ほぼ全てが尿中に排泄されます。尿管に移行したASP5354の蛍光をNIR-Fカメラを用いて捉えることにより、尿管が可視化され、手術中に尿管の位置を術者が認識することができます。なお、ASP5354は、三重大学および名古屋大学が発見した化合物で、アステラス製薬が全世界における独占的な開発・販売権を取得しています。
これまでに実施された第I相試験において、健康人におけるASP5354の高い忍容性と安全性が確認されており、現在は消化器外科手術を受ける患者においてASP5354の安全性と有効性を検証する第II相試験を実施中です。ASP5354の臨床試験の詳細については、www.clinicaltrials.govをご覧ください。
アステラス製薬はRx+®事業を通じて、科学的根拠に基づくヘルスケアソリューションによって、心身ともに健康に、自分らしく生きることができる社会の実現を目指しています。その活動の中で、手術や診断の精度向上による医療手段の最適化および治療アウトカムの最大化に取り組んでおり、精密手術ガイドASP5354の開発もこの一環です。引き続き、医療機器技術と製薬技術の融合により、より精密かつ安全な手術法の確立に寄与する様々なソリューションを提供していきます。
以上