細胞医療への挑戦~他家多能性幹細胞由来の分化細胞を用いたビジネスモデルを追求~

世界が注目し、多くの企業や研究機関が取り組む細胞医療の研究開発において、アステラスは、その実用化に向けて着実に前進しています。私たちのアプローチは、他家多能性幹細胞由来の分化細胞を用いた治療法の研究を中心としています。オフザシェルフ(既製品)として大量製造が可能であり、一般的には自家細胞医療製品と比べて製造コストが抑えられるため、実用化に適しているからです。眼科領域においては、すでにリードプログラムを臨床試験に進めており、さらに自己免疫疾患、心血管疾患、がんなど、アンメットメディカルニーズの高い領域でのパイプラインの強化にも取り組んでいます。
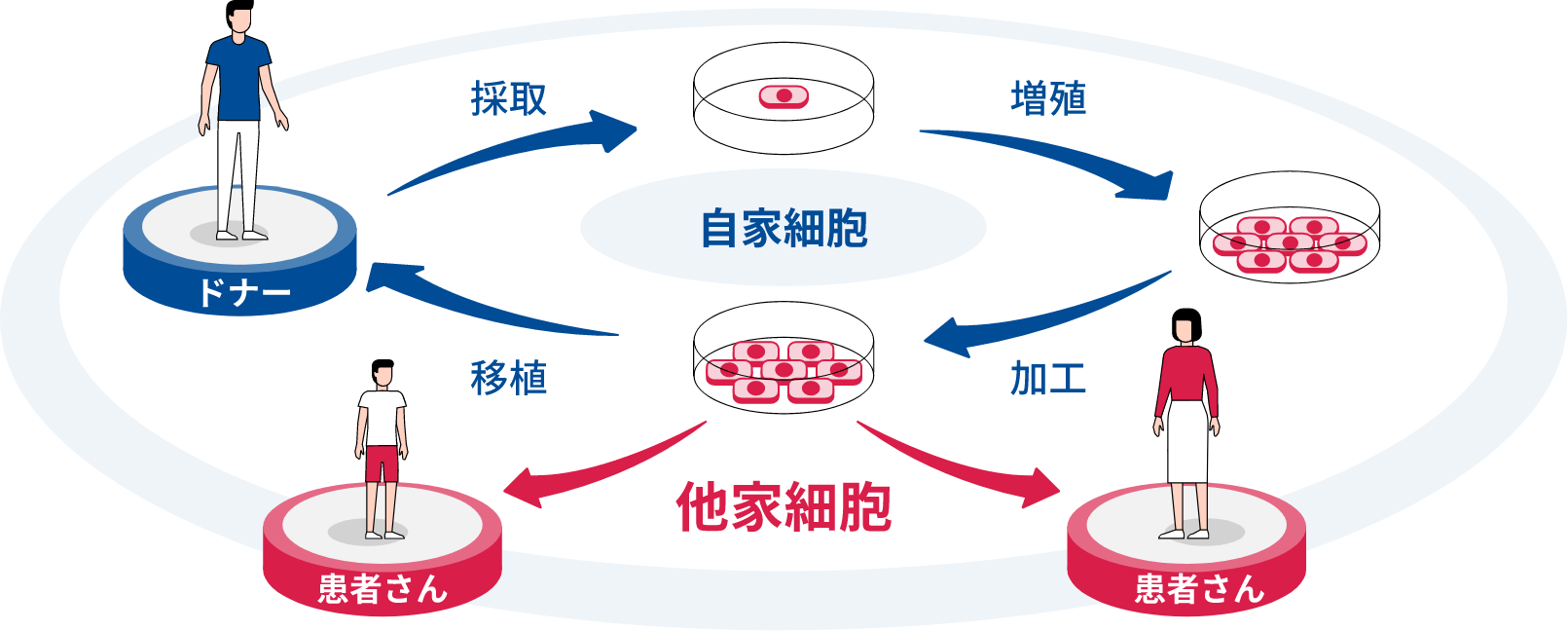
患者さんの治療選択肢を広げる細胞医療製品の実用化を推進
アステラスでは、2030年を細胞医療開発のターニングポイントと捉えています。この頃までには細胞医療の対象疾患や病態が広がり、細胞医療製品が既製品として普及し、多くの患者さんがその恩恵を受けられる社会が到来すると予想しています。再生医療全体の市場規模が、2030年には全世界で12兆円に達し、2050年には38兆円規模にまで成長*1するという予測もあることから、商用化に向けた競争が今後ますます加速すると考えています。
このような予測のもと、アステラスは、細胞医療の研究開発拠点を米国マサチューセッツ州ボストンのアステラス インスティチュート フォー リジェネレイティブ メディシン(AIRM)に集約しています。
AIRMの代表を務める後藤正英は、アステラスのユニークかつ革新的な取り組みをこう語ります。
「私たちが採用している、他家多能性幹細胞由来の分化細胞を用いた治療法の研究アプローチは、チャレンジングなものです。しかしながら、これを達成することで、患者さん自身から採取した細胞を体外で増やして戻す自家多能性幹細胞を用いるよりも、極めて短期間での治療が可能になり、幅広いニーズに応えることができると考えています」
一方で、他家多能性幹細胞由来の分化細胞には免疫拒絶反応という課題がある、と後藤は指摘します。さらに試験管や培養器などを用いた人工的な環境下での実験から動物などによる生体内での実験、ヒトによる臨床試験、そして量産化へと細胞医療製造バリューチェーンが進むにつれ直面する各フェーズで新たな課題に対し、「適切なパートナーシップの形成やイニシアチブを通じ、多くの課題解決に取り組んでいます」と強調します。
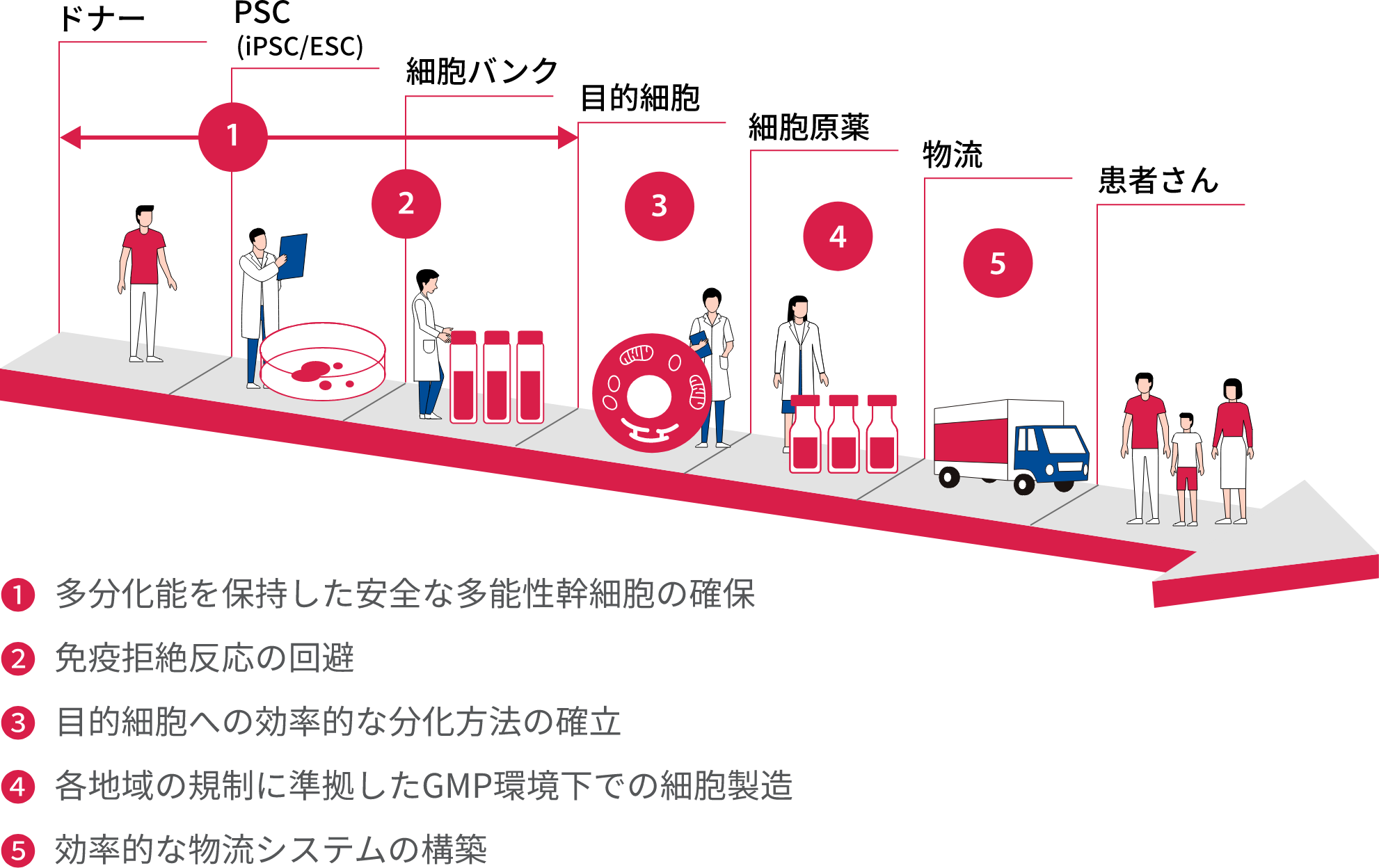
現在AIRMでは堅牢な幹細胞基盤技術の拡張、安全性と品質を担保した多機能性幹細胞パイプラインの拡充、目的細胞への効率的な分化方法の確立、免疫拒絶反応を回避する技術の導入に取り組んでいます。さらにGMP(Good Manufacturing Practice/医薬品および医薬部外品の製造管理および品質管理の基準)レベルの細胞製造を実現するために、当局と協議し、合意が得られたことは大きな意義があります。また、大量製造に向けたケイパビリティの確立、効率的な物流システムの構築も順調に進んでいます。また、医薬品製造において多彩な製造技術を持つ私たちの強みを活かして、自社内における細胞製造技術を飛躍的に進展させました。製品の保管、搬送などの課題をクリアすることで、より多くの患者さんに細胞医療製品をお届けできると考えています。
*1 経済産業省「再生医療・遺伝子治療の産業化に向けた 基盤技術開発事業 複数課題プログラムの概要」より
細胞医療製品が患者さんに届くまでの課題
※PSC:多能性幹細胞、iPSC:人工多能性幹細胞(iPS細胞)、ESC:胚性幹細胞(ES細胞)
眼科領域のリードプログラムで臨床試験を進行中
眼科領域では、地図状委縮を伴う加齢黄斑変性を対象とする網膜色素上皮細胞プログラムの臨床試験を実施中です。また、緑内障、網膜色素変性症などを対象とした複数のプログラムも進行しています。さらに眼科領域以外でも、クローン病などの自己免疫疾患治療のための血管芽細胞由来間葉系幹細胞、重症下肢虚血治療のための血管前駆細胞およびがんで使用するための様々な細胞を用いた細胞医療研究も進めています。
「私たちが、最初に眼科領域からスタートした理由は複数あります。目が直接アクセスできる部位であること、細胞医療製品を投与しやすく全身麻酔が不要なこと、さらに他の臓器に比べて小さく、必要とする細胞数が少なくて済むなど、品質保証や物流面でのメリットがある」と、後藤は語ります。
さらに、アステラスにおける細胞医療の研究開発を振り返り、大きな転機となった出来事について強調します。
「2016年にオカタ(Ocata)社を完全子会社化したことにより、眼科領域のリードプログラムを獲得しました。当時のオカタ社は、30名程度の米国のバイオベンチャーでしたが、既に幹細胞の分化誘導研究において数々の研究実績がありました。オカタ社の技術が、私たちの臨床試験に大きく寄与することになりました。また、世界有数の細胞医療におけるトップサイエンティストとして知られるオカタ社のロバート・ランザ(Robert Lanza)博士が、2022年2月までAIRMのCSO(Chief Scientific Officer/最高科学責任者)を務め、私たちの研究開発をリードしました。」

イノベーションを起こす研究拠点で、優秀な人材が能力を発揮
2020年1月、ボストン近郊にAIRMの新たな施設を開設しました。総床面積24,000㎡におよぶ広大な敷地を有し、細胞医療研究に加えて、臨床開発やGMP製造までカバーされた最先端の拠点です。ここには世界中の患者さんの治療に細胞医療を役立てたいと願う人材が集い、さまざまな役割を担っています。

AIRMには細胞医療や関連分野における世界トップレベルの研究者が所属しており、研究開発から製造までカバーする設備も整っています。すなわち、多能性幹細胞の調達から遺伝子編集、目的細胞への分化など、最先端の細胞医療の研究開発能力が備わっているといえます。私の使命は、研究チームが目的をスムーズかつ安全に達成できるように、緊密な連携とサポートを行い、ひいては科学の進歩を患者さんの将来の価値に変えることです。これにより、外部パートナーの皆さまから、AIRMを最適なパートナーとしてお選びいただきたいと考えています。
リチャード・キャシディ
オペレーション&コマーシャル責任者

私は、AIRMでパイプラインの戦略的計画の立案、再生医療の研究および初期の製品開発におけるチームマネジメントを担っています。AIRMにはバイオベンチャー企業が持つ革新的な技術と、大規模な製薬企業のグローバルな経営基盤・資源・支援体制が融合した環境が整っています。このことにより、初期段階の研究開発や外部研究者との協業、IND(Investigational New Drug/治験許可申請)、臨床試験、商業化まですべての工程を自社内で行えることが強みといえます。細胞医療の研究者という立場で、アンメットメディカルニーズの高い疾患を持つ患者さんに価値を提供できるよう、多能性幹細胞由来の細胞医療の実現化を目指しています。
エリン・キンブレル
エグゼクティブディレクター(再生医療)

私は、安全な多能性幹細胞の確保や分化や増殖など、細胞の働きに関与する転写因子の検索などを行っています。現在は眼科領域の研究チームとの協業で、転写因子を使用した網膜の細胞種の拡充を目指しています。私の専門であるエピジェネティクス(DNA塩基配列の変化を伴わない細胞分裂後も継承される遺伝子発現あるいは細胞表現型の変化を研究する学問領域)やリプログラミングの専門性と、転写因子と組み合わせて、再生医療へ応用するための橋渡し研究に応用できることは本当に幸運です。また、AIRMには多様性、包括性に富んだ文化があり、科学的な議論、コラボレーションがしやすい環境が整っています。研究者は皆、自分のプロジェクトに懸命に取り組むとともに、互いをサポートし、日々意見交換をしています。このような学際的なコラボレーションは、私たちが成果を出すうえで重要です。
アナ・ダレッシオ
プリンシパルサイエンティスト(眼科チーム)
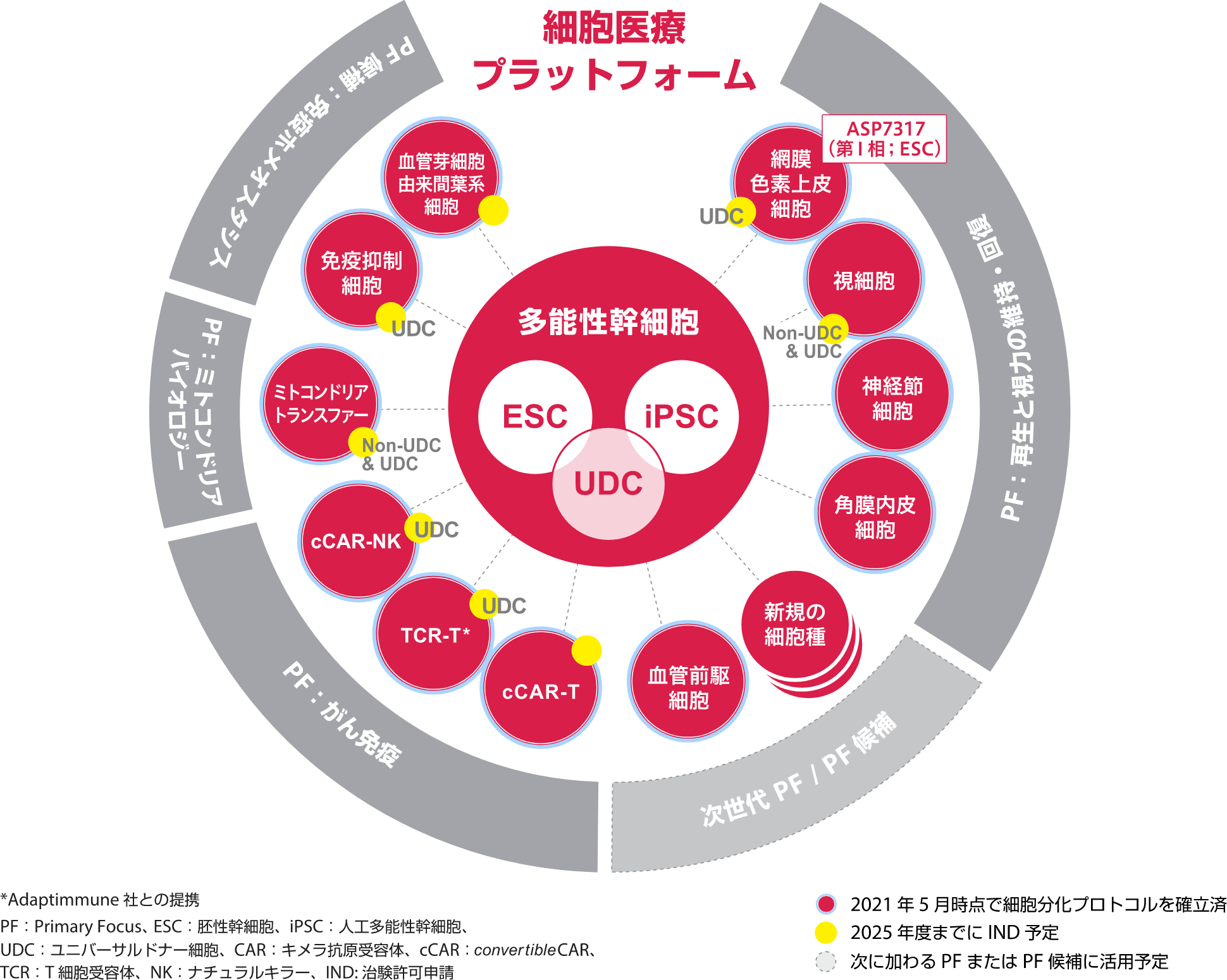
未来に向けた細胞医療プラットフォームの発展
アステラスの研究開発の特徴は、Focus Areaアプローチにあります。Focus Areaアプローチでは、革新的なバイオロジーやモダリティ/テクノロジーの組み合わせにより可能となる、アンメットメディカルニーズの高い疾患の克服を目指しています。複数の新薬候補が生み出され、リード化合物が臨床段階まで進んだ時に、最優先で経営資源を投下する領域を、Primary Focus(プライマリ・フォーカス)として社内で認定しています。
現在、「再生と視力の維持・回復」、「ミトコンドリアバイオロジー」、「遺伝子治療」、「がん免疫」の4つをPrimary Focusとして認定し、重点的な研究開発投資を行い、組織全体でバックアップしています。今まで、細胞医療プラットフォームは、Primary Focusのうち「再生と視力の維持・回復」でしか活用されていませんでしたが、「がん免疫」や「ミトコンドリアバイオロジー」でも有機的に活用されるようになり、この3年でパイプラインの充実化を達成しました。2025年にはさらに、さまざまな疾患領域への展開に向けて細胞医療プラットフォームを発展させていきます。
「アステラスは細胞医療の研究開発の第一段階にいる」と、後藤は語ります。
「私たちは、まずリードプログラムを患者さんの治療に繋げ、バリューチェーンの基盤を確立する必要があります。それから、他家多能性幹細胞由来の分化細胞における最大の課題である免疫拒絶反応を抑える技術を活用し、第二段階へと繋げていきます」
第二段階の中核となるのは、2018年に完全子会社化したユニバーサルセルズ(Universal Cells)社が保有するUDC(Universal Donor Cell/ユニバーサルドナー細胞)技術です。これは細胞への遺伝子導入ツールの一つである遺伝子組換えアデノ随伴ウイルス(rAAV)を用いた遺伝子編集技術に基づきヒト白血球型抗原を改編することで、免疫拒絶反応を抑えた多能性幹細胞を作製する技術です。この技術を活用し、眼科領域から、自己免疫疾患、がん、ミトコンドリア関連疾患領域などへと細胞医療プラットフォームの領域を拡大していきます。
第三段階では、多能性幹細胞技術と遺伝子編集技術を組み合わせた次世代高機能性細胞の創製を目指します。
アステラスにおける細胞医療研究の現在地は、まだ序章にすぎない、と後藤は語ります。
「まだ基礎研究が始まったばかりですが、アステラスでは、例えば投与した細胞によって機能を再生させるだけでなく、同時に栄養因子を放出してその周りの細胞に栄養を与えるなど、過去に前例のないような機能を活用し、細胞医療の可能性を探求しています」
細胞医療は、世界が注目する次世代のモダリティです。その中で、他家由来の多能性幹細胞を用いた細胞医療の研究開発において、アステラスはトップランナーという自負があります。
私たちは、2030年頃までには細胞医療が現実のものとなり、さらに対象疾患の広がりによって多くの患者さんがその恩恵を受けている未来を目指し、引き続き実用化に向けて邁進します。
ロバート・ランザ博士(AIRM最高科学責任者*)からのメッセージ

AIRMにおける私の役割は、複数の疾患領域にわたる細胞を由来とした再生医療の製品開発を管理し、戦略の方向性をリードする責任者です。AIRM内の各リーダーや研究チームと緊密に連携し、AIRMを含むアステラス全体の再生医療における科学的ビジョンを策定・実施し、最先端の生物化学に取り組んでいます。また、アステラスの研究者、薬事担当者、臨床担当者、さらには世界中の主要な学術チームとも密接な協力関係にあります。再生医療分野における私の使命は、細胞医療の広範な可能性を追求し、現在治療法がない病気に対する革新的な治療法を確立することです。
*2022年2月以降はAIRMのコンサルタントを務めています。
用語解説
オフザシェルフ:
個別化医療では、患者さんのタイプに合わせて最適な治療法を選択し、製剤一つ一つが全く同じではなく、調製・製造を製品ごとに実施する場合が多い。これに対し、オフザシェルフ製剤は既製品化され、必要な患者さんにすぐに投与可能である。 細胞医療では、他家由来細胞を用いることにより、オフザシェルフ製剤化する可能性が検討されている。
Investigational New Drug(治験許可申請):
米国における新医薬品の臨床試験届出制度。米国では製品ごとに治験開始前にFDA(Food and Drug Administration:食品医薬品局)に治験許可申請を提出することが義務付けられている。
地図状萎縮を伴う加齢黄斑変性:
加齢黄斑変性とは、加齢、紫外線、喫煙、遺伝、生活習慣等により、網膜の中心部(黄斑部)の組織が障害され、視力が著しく低下する疾患。異常な血管新生を伴う滲出型と、黄斑部が徐々に変性する萎縮型の2種類がある。萎縮型の患者の黄斑部が、網膜検査を行った場合に地図のようにみえることがあり、地図状萎縮という用語が使用されている。現在、萎縮型の加齢黄斑変性に対する明確な有効性を示す治療法は確立されていない。
UDC(Universal Donor Cell)技術:
患者のヒト白血球型抗原(HLA)型不適合による免疫拒絶反応を抑える細胞で、移植する細胞の遺伝子編集を行うことで、HLAを細胞から除き、免疫抑制性のHLA−Eに単一化する技術。免疫抑制剤が不要で末梢疾患への適応が可能。
関連リンク