
私たちの研究活動
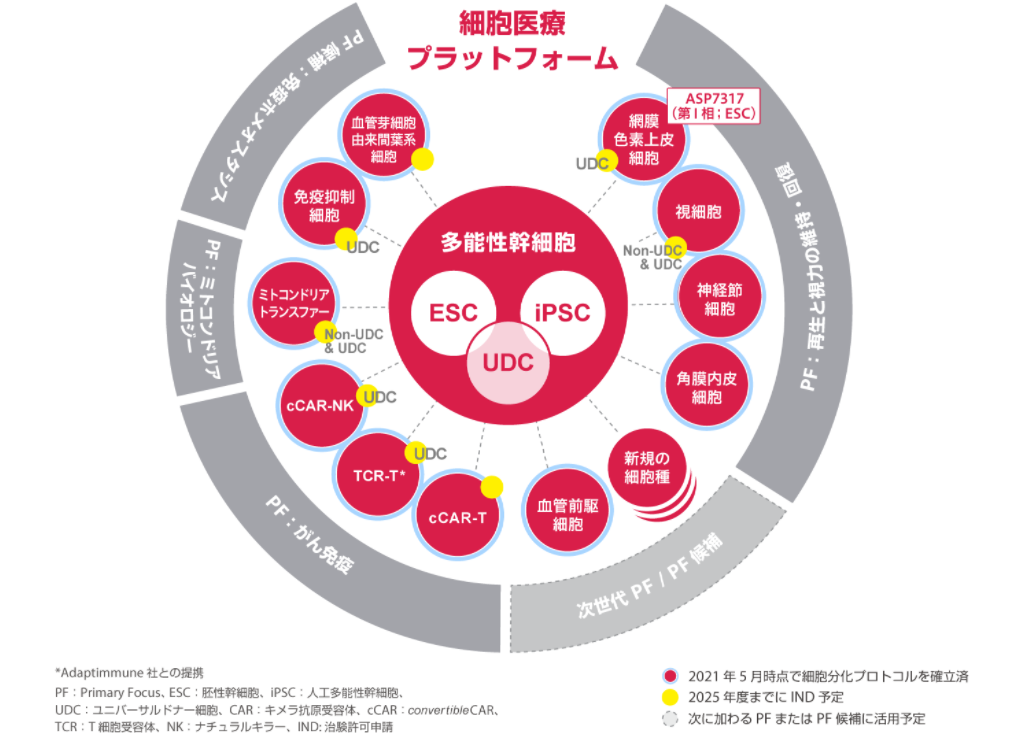
アステラス インスティチュート フォー リジェネレイティブ メディシン(AIRM)は、損傷した組織を再生あるいは置換することで様々な病態を改善させる多能性幹細胞由来の細胞医療製品を創出する役割を担っています。あらゆる患者さんに使用できる“オフザシェルフ(既製)”細胞医療製品の開発を目指し、眼科領域を突破口として、がん、自己免疫疾患、血管疾患など他の多くの治療分野へ革新的な製品の開発パイプラインを展開しようとしています。
ボストン郊外の広さおよそ25,000平方メートルの最新鋭の研究施設では、研究部門と製造部門が同じ屋根の下、将来の商業化ニーズに応えられる製造法の検討も進めながら、新たな治療手段の開発に取り組んでいます。
アプローチ
AIRMでは、私たちの持つ細胞工学技術をもとに新たな治療法を開発し、これをアンメットメディカルニーズの高い疾患に応用することに注力しています。
眼科領域では、患者さんの失明につながる可能性が高い、後眼部疾患の治療への応用に取り組んでいます。この新しいアプローチは、既存の治療手段では十分な処置を施すことが難しい眼疾患の患者さんにとって新たな希望となる可能性があります。現在、眼科領域では加齢黄斑変性症、緑内障、網膜色素変性症に取り組んでいます。
もう一つの注力領域は細胞医療を用いた革新的ながん治療です。例えば、私たちが取り組んでいる他家由来CAR細胞によるがん治療は、もし成功すれば多くのがん種に応用可能な、これまでにない治療手段になる可能性があると考えられています。しかしこれらアプローチの実現には多くの課題があります。すなわち安全性、腫瘍への指向性、細胞傷害活性などが絶妙にバランスされた製品をデザインし製造できる高度な技術に加え、オフザシェルフ(既製品)の細胞医療製品を安定的に供給するためのプロセス開発および製造実施能力も必要です。私たちは、様々な先端技術とアステラスの細胞医療チームの総力を結集してこれらの課題を乗り越え、患者さんに新たな治療の選択肢を提供することを目指します。
さらに、この2つの先行領域で培った科学的・技術的な知見を、自己免疫疾患や血管関連疾患など他の疾患領域へも展開していきたいと考えています。
AIRMは、治療法のない疾患に苦しんでおられる患者さんに新たな「価値」を提供するための挑戦を続けます。
Primary Focus 「再生と視力の維持・回復」、「がん免疫」のページも併せてご覧ください。また「細胞医療」についてはこちらのページをご覧ください。
チーム
リーダーシップ

社長
Erin Kimbrel, PhD
分子腫瘍学から再生医療まで、幅広い分野で25 年以上の経験を持つ。Advanced Cell TechnologyやOcata Therapeutics など複数のバイオテクノロジー企業を経て、2021年からAIRM の研究担当Vice President。眼科、自己免疫疾患、血管疾患などさまざまな領域で、 ヒトES細胞 および iPS細胞由来の細胞医療の研究チームを率いる。2024年4月より現職。
発表論文
Bertera et al. Human hemangioblast-derived mesenchymal stem cells promote islet engraftment in a minimal islet mass transplantation model in mice. Frontiers in Medicine, 8: 660877 (2021).
Kimbrel and R. Lanza. Next Generation Stem Cells – Ushering in a New Era of Cell-Based Therapies. Nature Reviews Drug Discovery 19(7): 463-479 (2020). doi: 10.1038/s41573-020-0064-x. Epub 2020 Apr 6.
Barnea-Cramer et al, Function of human pluripotent stem cell-derived photoreceptor progenitors in blind mice. Nature Scientific Reports 2016 Jul13;6:29784. doi: 10.1038/srep29784
Ferrer et al, Treatment of perianal fistulas with human embryonic stem cell derived MSCs: a canine model of human fistulizing Crohn’s disease. Regenerative Medicine 2016 Jan;11(1):33-43. doi: 10.2217/rme.15.69
McCabe et al. Efficient Generation of Human Embryonic Stem Cell-Derived Corneal Endothelial Cells by Directed Differentiation, PLoS One 10(12):e0145266 (2015). doi: 10.1371/journal.pone.0145266.
Kimbrel, E.A., and Lanza, R. Current Status of Pluripotent Stem Cells: Moving the First Therapies to the Clinic. NATURE REVIEWS Drug Discovery 14(10):681-692, 2015. doi: 10.1038/nrd4738
Schwartz, S.D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt’s macular dystrophy: follow-up of two open-label phase 1/2 studies. The Lancet 385: 509-516, 2015.
Kimbrel, E.A., et al. Mesenchymal stem cell population derived from human pluripotent stem cells displays potent immunomodulatory and therapeutic properties. Stem Cells and Development, 23(14):1611-1624, 2014. doi: 10.1089/scd.2013.0554.
Lu, B., et al. Long-term Safety and Function of RPE from Human Embryonic Stem Cells in Preclinical Models of Macular Degeneration. Stem Cells, 27(9):2125-2135, 2009
Agarwal, S., et al. Efficient differentiation of functional hepatocytes from human embryonic stem cells. Stem Cells 26: 1117-1127, 2008. doi:10.1634/stemcells.2007-1102
Klimanskaya, I., et al. Human embryonic stem cell lines derived from single blastomeres. Nature, 444:481-485, 2006.
Klimanskaya, I., et al. Derivation and comparative assessment of retinal pigment epithelium from human embryonic stem cells using transcriptomics. Cloning and Stem Cells, 6(3): 217-245, 2004.
*AIRM previously known as Ocata Therapeutics and Advanced Cell Technology
採用・お問い合わせ